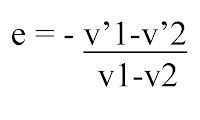IMPULS DAN MOMENTUM
A. MOMENTUM
Dalam fisika, momentum berkaitan dengan kuantitas gerak yang dimiliki oleh suatu benda yang bergeak yaitu kecepatan. Dalam hal ini, momentum didefinisikan sebagai hasil kali antara massa dan kecepatan benda.
Secara matematis momentum dapat ditentukan dengan persamaan,
p = m.v
dengan, m = massa benda (kg)
v = kecepatan benda (m/s)
p = monetum benda (kg.m/s)
Karena kecepatan merupakan besaran vektor, sedangkan massa merupakan besaran skalar, maka momentum merupakan besaran vektor. Jadi momentum mempunyai nilai dan arah.
Contoh :
Sebuah benda bermassa 10 kg bergerak ke kanan dengan kecepatan 5 m/s. Untuk menyatakan momentum benda tidak cukup dengan menyatakan benda memiliki momentum sebesar 50 kg.m/s, tetapi arahnya harus disebutkan. Dalam hal ini benda memiliki momentum sebesar 50 kg.m/s ke kanan.
B. IMPULS
Apabila sebuah gaya F bekerja pada sebuah benda bermassa m dalam selang waktu tertentu ∆t sehingga kecepatan benda tersebut berubah, maka momentum benda tersebut akan berubah. Dalam hal ini, berdasarkan hukum kedua Newton dan definisi percepatan, maka diperoleh persamaan berikut,
Jika kedua persamaan di atas disubstitusikan, akan diperoleh persamaan,
F. ∆t = mv2 – mv1
F. ∆t dinamakan impuls, dan mv2 – mv1 adalah perubahan momentum (momentum akhir - momentum awal). Dengan demikian diperoleh hubungan impuls dan momentum sebagai berikut,
I = F. ∆t = ∆p = mv2 – mv1
dengan, I = impuls (N.s)
F = gaya (N)
∆t = selang waktu (s)
∆p = perubahan momentum (kg.m/s)
Dari persamaan di atas dapat dikatakan, impuls adalah perubahan momentum yang dialami suatu benda.
C. HUKUM KEKEKALAN MOMENTUM
Dua benda bergerak saling mendekat dengan kecepatan v1 dan v2 seperti tampak pada gambar berikut. Kedua bola akan bertumbukan sehingga setelah tumbukan benda (1) akan berbalik arah ke kiri dengan kecepatan v1 dan benda (2) akan berbalik arah ke kanan dengan kecepatan v2.
Perhatikan gambar berikut!
Pada peristiwa semua tumbukan akan berlaku hukum kekekalan momentum, sehingga pada proses tumbukan tersebut berlaku,
“momentum kedua benda sebelum tumbukan sama dengan momentum kedua benda setelah tumbukan”
sehingga berlaku persamaan,
m1 v1 + m2 v2 = m1 v1 + m2 v2
p1 + p2 = p1 + p2
Persamaan di atas disebut dengan hukum kekekalan momentum. Dalam hal ini hukum kekekalan momentum menyatakan bahwa “jumlah momentum benda sebelum tumbukan sama dengan jumlah meomentum benda setelah tumbukan”.
D. JENIS-JENIS TUMBUKAN
Peristiwa tumbukan antara dua buah benda dapat dibedakan menjadi beberapa jenis, yaitu :
tumbukan lenting sempurna
tumbukan lenting sebagian
tumbukan tidak lenting sama sekali
Perbedaan tumbukan = tumbukan tersebut dapat diketahui berdasarkan nilai koefisien tumbukan (koefisien restitusi) dari dua benda yang bertumbukan.
Secara matematis, koefisien restitusi dapat dinyatakan dengan persamaan,
dengan, e = koefisien restitusi (0 ≤ e ≤ 1)
1. Tumbukan Lenting Sempurna
Tumbukan antara dua buah benda dikatakan lenting sempurna apabila jumlah energi kinetik benda sebelum dan sesudah tumbukan tetap, sehingga nilai koefisien restitusi sama dengan 1 (e = 1).
Sehingga pada tumbukan lenting sempurna berlaku hukum kekekalan momentum dan hukum kekekalan energi kinetik, persamaan yang digunakan adalah :
2. Tumbukan Lenting Sebagian
Pada tumbukan lenting sebagian, hukum kekekalan energi kinetik tidak berlaku karena terjadi perubahan energi kinetik sebelum dan sesudah tumbukan. Pada tumbukan lenting sebagian hanya berlaku hukum kekekalan momentum saja dan koefisien restitusi tumbukan lenting sebagian mempunyai nilai diantara nol dan satu.
Persamaan yang digunakan adalah :
3. Tumbukan Tidak Lenting Sama Sekali
Tumbukan antara dua buah benda dikatakan tidak lenting sama sekali sesudah tumbukan keduabenda menjadi satu (bergabung), sehingga kedua benda memiliki kecepatan sama yaitu v’.
v’1 = v’1 = v’
Pada tumbukan tidak lenting sama sekali, jumlah energi kinetik benda sesudah tumbukan lebih kecil dibanding jumlah energi kinetik benda sebelum tumbukan. Jadi pada tumbukan ini terjadi pengurangan energi kinetik.
Nilai koefisien restitusi pada tumbukan tidak lenting sama sekali adalah nol (e = 0).
Sehingga pada tumbukan tidak lenting sama sekali berlaku persamaan matematis :
m1 v1 + m2 v2 = (m1 + m2 ) v’